主な論文:
Interaction of maleimidobenzoyl actin with
myosin subfragment 1 and tropomyosin-troponin.
Miki,
M. and Hozumi, T. (1991)
Biochemistry 30, 5625-5630.
Detection of conformational changes in
actin by fluorescence resonance energy transfer between Tyrosine-69 and
Cysteine-374.
Miki,
M. (1991)
Biochemistry 30, 10878-10884.
Removing the two C-terminal residues of
actin affects the filament structure.
O'Donoghue,
S., Miki, M., and dos Remedios, C. (1992)
Arch. Biochem. Biophys. 293, 110-116.
Structure of actin observed by fluorescence
resonance energy transfer spectroscopy.
Miki,
M., O'Donoghue, S. , and dos Remedios, C. (1992)
J. Muscle Res. Cell Motil. 13, 132-145.
The mechanism of inhibition of the
actin-activated myosin Mg-ATPase by calponin.
Miki,
M., Walsh, K. P., and Hartshorne, D. J. (1992)
Biochem. Biophys. Res. Commun. 187, 867-871
Kinetics of Structural Changes of
Reconstituted Skeletal Muscle Thin Filaments Observed by Fluorescence Resonance
Energy Transfer
Miki,
M. and Iio, T. (1993)
J. Biol. Chem. 268, 7101-7106
Domain motion in Actin Observed by
Fluorescence Resonance Energy Transfer
Miki,
M. and Kouyama, T. (1994)
Biochemistry 33, 10171-10177
Domain motion in Actin: Determination of
Interdomain Distance Distributions by Time-Resolved Fluorescence Energy
Transfer
Miki,
M., and Kouyama, T. (1995)
Biophys
J. 68, 330s
Maleimidobenzoyl Actin: Its
Biochemical Properties with Heavy Meromyosin and In Vitro Motility.
Hozumi, T., Miki, M., &
Higashi-Fujime, S. (1996)
J. Biochem. 119, 151-156
Interhead Distances in Myosin Attached to F-actin
Estimated by Fluorescence Energy Transfer Spectroscopy.
Ishiwata,
S., Miki, M., Shin, I., Funatsu, T., Yasuda, K., and dos Remedios, C.
Biophys. J. 73,
895-904 (1997)
Ca2+-induced distance change between points
on actin and troponin in skeletal muscle thin filaments estimated by
fluorescence energy transfer spectroscopy.
Miki,
M., Kobayashi, T.,
Kimura, H., Hagiwara, A., Hai, H., and Maéda, Y.
J. Biochem. 123,
324-331 (1998)
Fluorescence resonance energy transfer between points
on tropomyosin and actin in skeletal muscle thin filaments: Does tropomyosin
move?
Miki,
M., Miura, T., Sano, K.,
Kimura, H., Kondo, H., Ishida, H., and Maéda, Y.
J. Biochem. 123,
1104-1111 (1998)
Conformational
changes of the troponin-tropomyosin complex on F-actin observed by fluorescence
resonance energy transfer measurements.
Hai,
H., Miura, T., Kobayashi, T., Maéda, Y., and Miki, M.
J.
Fluorescence (2000) 10, 193-201
Ca2+- and S1-Induced
Conformational Changes of Reconstituted Skeletal Muscle Thin Filaments Observed by
Fluorescence Energy Transfer Spectroscopy: Structural Evidence for Three States
of Thin Filament.
Hai, H., Sano, K., Maeda,
K., Maéda Y., and Miki, M.
J. Biochem. 131, 407-418 (2002)
Ca2+- and S1-Induced Movement of Troponin T
on Reconstituted Skeletal Muscle Thin Filaments Observed by Fluorescence Energy
Transfer Spectroscopy.
Kimura,
C., Maeda, K., Maéda, Y., and Miki, M.
J.
Biochem. (2002) 132 93-102
Ca2+- and S1-Induced Movement of
Troponin T on Mutant Thin Filaments Reconstituted with Functionally Deficient
Mutant Tropomyosin
Kimura, C., Maeda, K., Hai, H., and Miki, M.
J. Biochem. (2002) 132, 345 - 352
著書
生物工学実験書 改訂版
7.4.4
生体高分子の立体構造解析 p.468-473
社団法人 日本生物工学会編 培風館 2002年発行
Structural changes between regulatory
proteins and actin: A regulation model by tropomyosin-troponin based on FRET
measurements.
Miki,
M.
Results and Problems in Cell
Differentiation 36, 191-203, D. D.
Thomas and C. G. dos Remedios (Eds.): Molecular Interactions of Actin, Springer-Verlag, Berlin Heidelberg 2002
生物物理ハンドブック
6.11
アクチンの構造と機能
朝倉書店 (2003年出版予定)
図1 ステリックブロッキング説:カルシウムイオンが無い時、トロポミオシンはアクチン上のミオシン結合部位をブロックして、ミオシンとアクチンが相互作用できなくする。
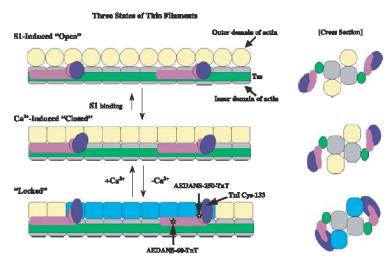
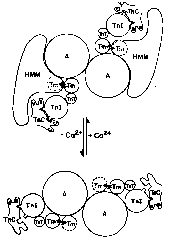
図2.新しい制御モデル: カルシウムイオンが無い時、TnIはアクチンのouterdomainに結合し、結果的にトロポミオシンとアクチンのouterdomainをクロスリンクする。2つのとなりあったトロポニンIによって囲まれたアクチン分子は不活性になる。(Kimura,
C., Maeda, K., Maéda, Y., and Miki, M. J. Biochem. (2002) 132 93-102)
研究室のメンバー(2003/6/26撮影)
-----------------------------------------------------------------------------------------
前列左から:木邑智恵子(博士研究員)、三木正雄(教授)、佐久間紹子 (M1)
2列目左から:任華 (M2)、中村明博 (B4)、鈴木貴之 (B4)
3列目左から:崎山慶太 (M1)、志鷹裕司 (D2)、松浦圭益 (M2)、小田洋士 (M1)
-------------------------------------------------------------------------------------------------------------------
研究室での実験風景


--------------------------------------------------------------------------------------------------------------------------
研究室の主要機器
(1)蛍光寿命測定装置

装置の概要 時間相関単一光子計測法による蛍光寿命や蛍光偏光解消度の測定。
キーワード 蛍光寿命、蛍光偏光解消度
装置の型 英国IBH社製 5000U
設置場所 工学部1号館1号棟2階 BI-208
主な仕様 1)光源:水素ガス封入フラッシュランプ、紫外LED(発光ダイオード), 青色 LED, 及び、紫LD
2)励起側、蛍光側にモノクロメーター
3)100ピコ秒時間分解能
4)モーター駆動偏光子による蛍光偏光度自動測定可能
5)減衰解析ソフトウエア:4成分までのデコンボルーション解析、異方性、グローバルデータセット、エネルギー移動モデル、及び寿命分布。
(2)ストップフロー吸光蛍光分光計(Sx.18MV)

装置の概要 ラピッドミキシングによる2液混合後のミリ秒の反応を追跡できる。
キーワード 反応速度、蛍光、タンパク構造変化
装置の型 英国アプライドフォトフィジック社製 SX.18MV
設置場所 工学部1号館1号棟2階 BI-208
主な仕様 1)150W キセノンアークランプ光源
2)200-850 nmの回折格子
3)吸光用、蛍光用のフォトマル装備
4)蛍光偏光検出器により蛍光偏光度のストップトフロー測定可能
5)最低試料容量は1液 50 ml 以下
6)
デッドタイムは1.3 ms 以下
 (3)定常光励起蛍光測定装置
(3)定常光励起蛍光測定装置
装置の概要 蛍光測定
キーワード 蛍光エネルギー測定、蛍光スペクトル
装置の型 パーキンエルマー
設置場所 工学部1号館1号棟2階 BI-208
-----------------------------------------------------------------------------------------------
高校生(受験生)への一言:
ここ数十年の科学の進歩は目覚ましい。今迄別々の学問分野のものが、今や大きく重なって新しい学問分野ができている。一つの専門分野だけでなく、広い視野が必要である。その為にも、科学だけでなく、すぐれた文学や歴史作品もどんどん読んで、豊かな心を持つ人間になって欲しい。
研究室に望ましい学生:
物理や化学がきらいで、生物をやるというのではなく、物理や化学の基礎的なことを十分勉強し理解したうえでなおかつ生物機械の巧妙さに興味があり、実験に意欲のある学生が望ましい。実験は単に手足を動かすということではなく手足以上に頭を働かさなければならないので、体力も必要であるが、計画性、慎重さ、几帳面さ、それにねばりも必要である。トロポニンの発見者である江橋節郎先生は実験成功の重要3条件として、運、鈍、根をあげられた。
-----------------------------------------------------------------------------------------
科学技術振興調整費総合研究「アクチンフィラメントの構造と動態の解析による筋収縮・調節機構の解明」は中間期において成果をとう為に2001年11月16—18日理化学研究所播磨研究所において、国内外から著明な研究者を招いてWorkshop “actin filaments, from structure to mechanism”を開催しました。その時の集合写真です。